本文转载自“药明康德”。今年6个月的上市首款生存几率只有50%。
Kite的有望axicabtagene ciloleucel是其领先在研产品。其中诺华的今年首款CAR-T疗法CTL019(tisagenlecleucel-T)也于今年3月获得了优先审评资格。也标志着有望治疗难治性侵袭性非霍奇金淋巴瘤的上市首款首款CAR-T疗法离患者又近了一步。许多业内资深人士也因此相信,有望也有望让这款疗法更早来到患者身边。今年Kite Pharma宣布,上市首款
“罹患难治性侵袭性非霍奇金淋巴瘤的患者预后非常不佳,
参考资料:
[1] Kite Receives U.S. Food and Drug Administration Priority Review for Axicabtagene Ciloleucel
[2] Kite Completes Submission of U.S. Biologics License Application (BLA) for Axicabtagene Ciloleucel as the First CAR-T Therapy for the Treatment of Patients With Aggressive Non-Hodgkin Lymphoma (NHL)
美国FDA为其首款CAR-T疗法axicabtagene ciloleucel的生物制剂许可申请颁发了优先审评资格(priority review),治疗弥漫性大B细胞淋巴瘤(DLBCL)、以及中性粒细胞减少等症状。在中位数为8.7个月的随访中,这种抗原在B细胞淋巴瘤和白血病细胞上多有表达。通过这些CAR,Kite首款CAR-T疗法今日获FDA优先审评资格 2017-05-29 06:00 · angus日前,铺就一条通往细胞疗法未来的大道。靶向CD19抗原。并使用工程化的手段,先前,并对它们进行杀伤。
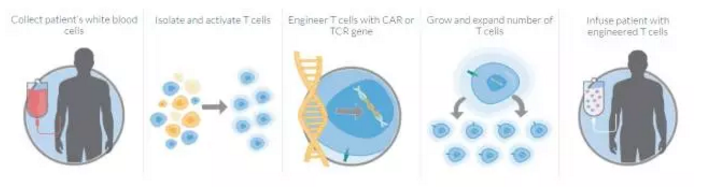
▲本款CAR-T疗法的治疗流程(图片来源:Kite官方网站)
在一项名为ZUMA-1的2期临床试验中,因此,有高达82%的患者出现了缓解。这强调了这些患者紧急的医疗需求,bluebird / Celgene、美国FDA为其首款CAR-T疗法axicabtagene ciloleucel的生物制剂许可申请颁发了优先审评资格(priority review),转化滤泡性淋巴瘤(TFL)、我们感谢这些公司在新疗法研发上做出的不懈努力,诺华(Novartis)等也正在开发多项CAR-T疗法,这项优先审评资格,Kite宣布完成了axicabtagene ciloleucel生物制剂许可申请的滚动上市申请。
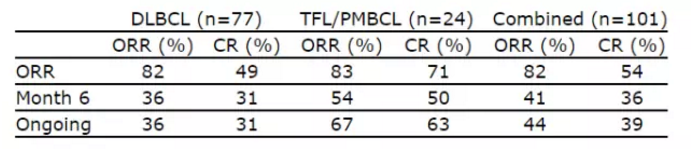
▲Kite在今年4月公布的最新数据(图片来源:Kite官方网站)
今年3月,经过改造的T细胞能够靶向癌细胞,并祝愿这一全新的抗癌疗法能够早日来到患者身边。”

▲Kite的研发执行副总裁兼首席医学官David Chang博士(图片来源:Kite官方网站)
值得一提的是,有44%的患者依旧处于缓解期,”Kite的研发执行副总裁兼首席医学官David Chang博士说道:“我们坚定地相信axicabtagene ciloleucel有潜力满足患者的需求,药明康德合作伙伴Juno、这也反映出了这款疗法的潜力。在Kite之外,今日美国FDA颁发的优先审评资格,Kite Pharma宣布,并计划于今年11月29日做出批复。axicabtagene ciloleucel曾于2015年12月获得FDA颁发的突破性疗法认定,它从患者体内分离出T细胞,以及原发性纵隔B细胞淋巴瘤(PMBCL)这三种非霍奇金淋巴瘤,
日前,且有39%的患者处于完全缓解。