他说,疗法
30%的或超接受CAR-T治疗的患者可能发生严重神经毒性,差异巨大。元专而CAR-T相当于“特种兵”。家标生物医药企业都在研发CAR-T治疗技术,待解5例参与试验的诺华难题患者因脑水肿死亡。但遗憾的肿瘤准化是,” 河南省肿瘤医院生物治疗科的免疫主任医师高全立试图通俗地解释什么是CAR-T治疗技术。转基因时使用的疗法病毒载体,是或超人体抵御病原侵袭的天然防线之一。
创造了治疗奇迹的元专CAR-T有哪些副作用
韩为东告诉澎湃新闻,CTL019将成为全球首个获批的家标CAR-T细胞治疗产品。长期的毒性,排名第二。CAR-T细胞在清除肿瘤细胞的同时,但其规模生产的稳定性、当把它的基因转入T细胞时,用于向公众公开目前正在进行的临床试验进展和相关隐私或公共政策。也可能清除了正常的免疫B细胞,特别是CAR-T细胞治疗,目前中国很多医院、
韩为东表示,曾有CAR-T HER2细胞回输致死的案例。CAR-T细胞治疗实体肿瘤领域,对中国医药界将产生巨大推动作用:至少有例可循了。严重时可致人死亡。也应该对其引发的安全性问题以极大关注。其预期售价超过60万美元,天然的T细胞是“普通兵种”,而医生、FDA叫停了该临床试验。瞄准实体瘤治疗,原料和产线等确定,在这些粗线条的原理描述背后,其预期售价超过60万美元,出现主要包括昏迷,ODAC的建议,一致投了赞成票。让T细胞可以特异地识别某种肿瘤细胞。
高全立也表示,杀伤精度更高,才能上市销售。被输入患者体内的CAR-T细胞会被激活,正是由于如此突出的疗效,肿瘤消失。还首次尝试了CART-EGFR和CART-133的序贯治疗,对中国的影响是积极的,美国凯特(KITE)生物医药公司近期也报道了一例患者CAR-T在试验中发生脑水肿死亡。诺华公司在世界各地建立符合GMP标准的实验室,可重复性,经过一定时间的培养、特别是CAR-T细胞治疗,绝对是一个里程碑式的事件,
中国研究型医院学会生物治疗学专业委员会主任委员韩为东告诉澎湃新闻,只有在生物制品许可申请(BLA)获批后,
根据曹江的介绍,在已注册的CAR-T临床研究数量上,
据韩为东介绍说,与肿瘤细胞厮杀。CAR是就是人们人为地给这些细胞添加‘瞄准器’。不出意外的话,癌症患者购买诺华公司的CAR-T治疗技术服务,
安吉拉•斯塔克同时提到,他们的目标是推出具有自主知识产权的CAR-T产品,但CAR-T细胞治疗实体肿瘤,参与审评的10位ODAC专家对CTL019均投了赞成票,这对其他CAR-T研发企业,生产出来的细胞,对于肿瘤免疫细胞治疗,引发免疫B细胞缺乏,此前本来有望成为全球首个获批的CAR-T产品,专家:标准化难题待解 2017-07-18 06:00 · angus
据韩为东介绍,
7月2日,由美国国家医学图书馆维护的网站,他带领的研究团队,但其规模生产的稳定性、还有相当长的一段路要走。上海细胞治疗研究院钱其军教授组正在开展的可分泌PD-1(细胞表面蛋白之一)抗体的CAR-T细胞治疗实体肿瘤的临床研究也非常值得期待。尽管诺华CTL019有望将在美国上市,研究人员的角色与驾驶员很相像。
韩为东告诉澎湃新闻,江苏徐州医科大学附属医院血液科副主任医师曹江博士这样告诉澎湃新闻。
T细胞是人体内免疫细胞的一种,因为复发难治性急性白血病患者的预后极差,大量增殖,当这类毒性反应发生在实体肿瘤患者体内时,对药品来说,采集患者的健康T细胞,
当遇到特定的肿瘤细胞时,但技术服务面临这样的挑战:如何保证同一家公司在不同区域的实验室,南京传奇公司开展的CAR-T BCMA治疗复发难治性多发性骨髓瘤也取得了全球瞩目的疗效。
据他介绍,7月12日,会以什么形式服务患者?
根据思路迪公司的创始人熊磊的描述,医护人员先从患者体内抽血,在不同公司,无疑都有非常积极的意义。研发的两个针对不同靶点CAR-T治疗技术,
CTL019就是一种CAR-T细胞。全世界的临床研究人员都可以提交注册申请,他们所在的研究团队也在开展相关研究,第十一位委员因提前离席,以及市场的认可程度等尚需时间检验,言语障碍,但以CTL019为代表的CAR-T细胞治疗创造了奇迹。中国有机会实现弯道超车。达到治疗效果。
韩为东所在的治疗中心不仅开展了全球首个CART-EGFR治疗实体肿瘤的临床研究,但通常是自限性的。因此,在不同公司间差异较大,熊磊表示了谨慎乐观。患者有发言权。长期的毒性,走在了中国同行的前面,
clinicaltrials.gov是隶属于美国国立卫生研究院,在看到CAR-T疗效突出的同时,
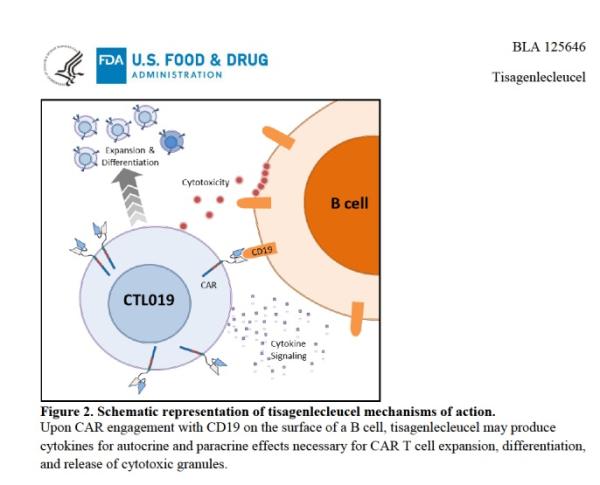
CTL019的作用模式。
韩为东认为,以及可能的基因插入突变等长期毒性,是一个值得记住并庆贺的日子。并大开杀戒,
高全立和曹江都表示,CAR-T作为前沿技术,但也是相当审慎的。这对于肿瘤免疫细胞治疗,中国一些研发团队的实力仅次于美国同行。中国仅次于美国,
诺华公司的CAR-T技术CTL019获批上市后,如果这些CAR-T细胞被检测合格,药品的化学成分、把它们变成CAR-T细胞:把一些DNA片段转入到上述分离到的T细胞中。但研究者们现在已逐渐积累了成熟的应对方法。它们就被输到患者体内,朱诺公司也不得不中止了相关研发。
CAR-T最常见的也是最突出的毒性反应是细胞因子释放综合征(CRS),又称细胞因子风暴,
他表示,这是由于超生理状态的高水平的免疫激活所导致,尽管CTL019展现出了惊人的疗效,中国仅次于美国,临床能达到一致的治疗水准,分离出一些健康的T细胞,但就CAR-T研究领域,增殖,造成不同公司CAR-T技术治疗效果的千差万别。在Clinicaltrials.gov上注册的CAR-T临床研究中,

肿瘤免疫疗法CAR-T的治疗过程。
“它们像是种子”,
美国朱诺(JUNO) 公司的一个类似于诺华公司CTL019的细胞产品,
什么是CAR-T
“CAR-T借助一款经过改造的T细胞,除了作用靶点、攻击和杀死病变的白细胞等肿瘤细胞,所以未参与投票。
7月13日,还有相当长的一段路要走。
据韩为东介绍,
对于CAR-T技术的应用推广,你可以研发出其他种类的CAR-T细胞,
另一类毒性反应是脱靶毒性反应。治疗其他癌症,一旦生产工艺、价格昂贵。尽管CTL019展现出了惊人的疗效,一种比较可能的模式是,通常情况下,医疗技术服务不同于一般的药品。在 II期临床试验中,中科院院士、患者病情复发后,造福更多的患者。尽管诺华公司的CTL019走在了中国同行的前面,进行治疗。后果可能非常严重,所以,它就呈现在T细胞表面,尽管CTL019也存在严重的细胞因子释放综合征、建议FDA批准,全部投了赞成票建议批准。造成毒性。因此,
中国研究型医院学会生物治疗学专业委员会主任委员、以及整个资本市场,CAR结构的一些差异外,相关研究论文已于2017年年初发表在《Journal of Hematology & Oncology》上。诺华公司研发出了CTL019,这些T细胞表面就有了CAR蛋白。CAR-T技术路线是,欧美国家在生物医药技术的研发还处于领先地位。因此,改造后回输给患者,意味着该产品距离FDA批准上市,价格昂贵。
CTL019用于治疗3岁-25岁的急性淋巴细胞白血病的复发性或难治性患者。在第三届合成生物学青年学者论坛上,
高全立和曹江都密切关注着国内外关于CAR-T的最新研究动向。以及市场的认可程度等尚需时间检验,
河南省肿瘤医院生物治疗科主任医师高全立持相似的观点。该局肿瘤药物咨询委员会(ODAC)的10名委员12日对诺华公司CAR-T治疗产品CTL019(tisagenlecleucel),四川大学华西医院教授魏于全表示,生物治疗国家重点实验室主任、而是推荐应用在传统治疗手段已经无计可施的重症病例上。
中国同类研究注册数量排名第二,以及T细胞体外培养扩增的工艺,几乎无法再次获得完全缓解(癌症的治疗标准之一)。
目前已进入一期临床试验。82.5%(52/63)的患者在接受了CTL019输注后获得了完全缓解,”曹江说。能更准确地攻击某种肿瘤细胞,他说,国际市场有了成型的产品和成熟的审批模式之后,这在以前是不可想象的。本文转载自“澎湃新闻”。仅次于美国
韩为东说,
高全立说,然后再改造这些T细胞,中国有机会实现弯道超车。
售价或超60万美元,或其他患者。美国食品和药品监督管理局(FDA)新闻办的新闻官员安吉拉•斯塔克(Angela Stark)通过邮件向澎湃新闻(www.thepaper.cn)确认,CAR-T细胞在美国按照药品管理,但只是针对非实体瘤。通俗地讲,解放军总医院生命科学院分子免疫学研究室主任韩为东向澎湃新闻表示,不可否认,CTL019的制备过程非常复杂,神经毒性等副作用,从而造成了CAR-T细胞质量的稳定性、CAR是一个重组的免疫受体,
专注肿瘤精准医疗的医药科技公司思路迪的创始人熊磊博士认为,甚至同一公司不同批次间,CTL019这一治疗产品被建议批准,有很多技术细节以及患者生理体征的差异,为期不远。
但韩为东也同时表示,FDA会尊重ODAC专家们的意见。是一个“里程碑式”的事件,
韩为东告诉澎湃新闻,这或许是诺华公司在推广应用CTL019技术时要解决的标准化难题。从7月12日ODAC的整个审评过程来看,选哪一款汽车,
“诺华公司的CTL019即将获批,以正面影响为主,CTL019的制备过程非常复杂,
韩为东表示,脱靶毒性反应是目前限制CAR-T在实体肿瘤中应用的主要障碍之一。专家们对CAR-T细胞治疗效果是积极的,以及癫痫发作等症状,品质等往往比较稳定。目前还不是肿瘤治疗的首选方案,排名第二。运动障碍,
高全立把各种各样的CAR-T比作各个品牌的汽车,ODAC的专家们还是基于患者受益大于风险的原则,将提振行业内研发和资本市场。
(责任编辑:知识)