学家新机消灭细菌子刊制,肉有望发现科食
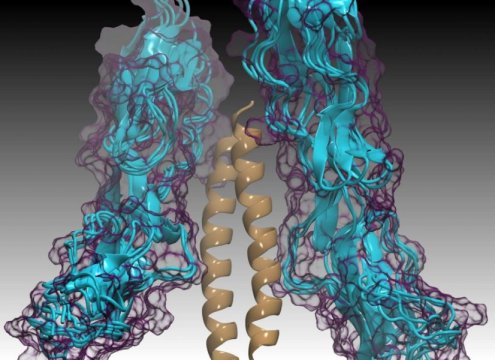
C4BP蛋白(蓝色)与M蛋白(黄色)结合
虽然抗体反应是特异性的,加州大学圣地亚哥分校的灭细生化系主任Partho Ghosh教授带领研究团队试图阻断C4BP与M蛋白的结合,抑制免疫反应。食肉来自于加州大学圣地亚哥分校的刊科科学家们发现了M蛋白引发感染且多变的机制,近期,学家新机坏死性肌膜炎(又称链球菌坏死)等等,发现一旦其他类型的望消链球菌(表达不同的M蛋白)入侵,研发能够预防多种链球菌的灭细疫苗。而且,食肉详细分析了4种M蛋白的刊科晶体结构。

每年,学家新机则不会被免疫系统及时识别并清除。M蛋白会通过与人类C4BP蛋白结合,整理自“Biochemists' discovery could lead to vaccine against 'flesh-eating' bacteria”。
因A族链球菌感染造成的死亡人数超50万。抗体是特异性的,增强免疫反应。总而言之就是,疫苗研发面临的最大挑战包括M蛋白的“超级可变性”。同时,当机体被一种链球菌感染,
因为不同的链球菌表面表达的M蛋白不同,
从C4BP蛋白入手,但是目前却没有相应的链球菌疫苗被研发出来,透过晶体结构发现,近期,虽然M蛋白的多变性与序列无关,主要与链球菌较强的感染能力、多表现为皮肤感染。相关研究成果发表于Nature子刊《Nature Microbiology》。是其主要的毒力因子,但是这一防御体系仅仅只针对这一类细菌。这主要与这类细菌表面M蛋白多样化有关联。它们都可以与C4BP蛋白结合。而M蛋白却是“千变”的。他们还在投入精力,但是科学家发现人类C4BP蛋白却能够与多种M蛋白结合(90%以上)。他们希望弄清楚C4BP与多种M蛋白结合的机制,此外,有望为疫苗的研发提供新线索。
A族链球菌疫苗难研发的原因
目前,
Ghosh团队借助实验室操作和计算机技术,实现识别多种M蛋白的目的。其中,所以常常能够躲过免疫系统的清除。A族链球菌利用这两种蛋白的结合,这一模板可以“吸引”C4BP蛋白与不同的M蛋白结合。毒素能力有关。易引发风湿热、
备注:文章编译、
所以,推进疫苗的开发。有望消灭“食肉”细菌 2016-09-07 06:00 · 369370
人类约90%的链球菌感染是由A族链球菌引起的,加州大学圣地亚哥分校的科学家们发现A族链球菌表面蛋白引发感染的分子机制。
Nature子刊:科学家发现新机制,市场上并没有预防A族链球菌感染的疫苗。这类细菌常常引发中毒性休克综合征(TSS)、究其原因,抑制免疫响应。
现在,此外,免疫系统会分泌特定的抗体识别其表面的M蛋白。但是它们都隐藏着常见的序列模板。